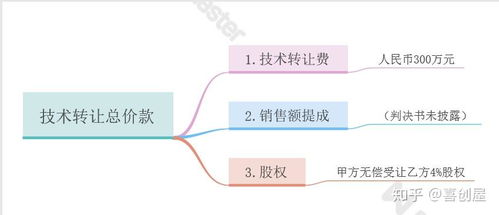
为适应药品监管新形势,鼓励技术创新与资源优化,国家药品监督管理局近期对药品技术转让的相关规定进行了重要修订。新版规定旨在进一步规范转让行为、保障药品质量、促进产业高质量发展。以下对其核心要点与潜在影响进行解读。
一、 新规核心变化与亮点
- 明晰转让范围与条件:新规对允许技术转让的药品类别进行了更清晰的界定,强调了转让方应具备的研发或生产历史,以及受让方应具备相应的生产条件、质量管理体系和责任承担能力。对于涉及重大工艺变更的转让,提出了更严格的药学对比研究和审评要求。
- 强化全过程质量监管:将质量管理贯穿于技术转让的全过程。要求转让前后进行深入的药品质量对比研究,确保关键质量属性(CQAs)保持一致或更优。强调了技术档案的完整、真实与可追溯性,要求对变更进行充分验证和评估。
- 优化注册申报程序:简化了部分情形的申报资料要求,并可能优化审评流程,旨在提高技术转让的效率。但对于生物制品、中药注射剂等高风险品种,依然维持更为审慎和严格的审评标准。
- 突出主体责任:明确并强化了转让双方,特别是受让方作为药品上市许可持有人的主体责任。要求其必须对转让后的药品质量、安全性、有效性负全责,确保技术转移的彻底性和生产持续性。
- 鼓励创新与资源整合:新规意在疏通技术流通渠道,鼓励研发机构、生产企业之间的优势互补,促进具有临床价值的药品品种(尤其是临床急需、罕见病用药等)能更高效地实现产业化,避免研发资源浪费。
二、 对行业的主要影响
- 对研发机构与创新企业:提供了更明确的成果转化路径,有利于保护知识产权价值,激励早期研发。但对技术包的完整性和数据质量提出了更高要求。
- 对生产企业(受让方):机遇与挑战并存。一方面,获得了丰富产品线、快速进入新治疗领域的机会;另一方面,必须投入资源全面提升技术接收、工艺验证和质量管控能力,责任风险显著增大。实力雄厚、体系健全的企业将更具优势。
- 对产业格局:预计将加速行业的专业化分工和整合。研发驱动型公司可更专注于前端创新,生产巨头则可凭借产能与质量体系优势,成为技术成果的“孵化器”和“放大器”。一些不具备持续生产条件或质量保障能力的企业,其产品批文通过技术转让流向优势企业的趋势可能会加强。
- 对药品质量与可及性:长期来看,通过规范转让、压实主体责任,有利于提升整体药品质量水平。高效的转让机制也有助于让更多好药、新药更快地到达患者手中,提升药品可及性。
三、 企业应对建议
企业应主动学习和理解新规精神,审视自身定位:
- 转让方:需系统梳理技术资料,确保其科学、完整、合规,为技术价值奠定坚实基础。
- 受让方:应着力构建强大的技术转移(TT)和质量保证(QA)团队,对拟接收的技术进行深度尽职调查,并做好充分的工艺验证和稳定性考察准备。
- 双方合作:建议在转让协议中详细约定技术移交内容、标准、时间表、支持义务、知识产权归属及责任划分,确保转移过程平滑、权责清晰。
新版药品技术转让规定是深化药品审评审批制度改革、落实药品上市许可持有人(MAH)制度的重要配套措施。它标志着我国药品技术转让管理向更科学、更规范、更高效迈进,必将对医药产业的创新生态与竞争格局产生深远影响。相关各方应积极适应,在合规框架下寻求发展机遇。